1、每次配制時,要注意其生產日期是否在保質期內,查看其開瓶日期及瓶口密封性,保證其未變質,并且未吸潮。
2、培養基配置時,稱量要準確,包括鹽水的分裝要準確。
3、一定要保證現配制現滅菌,未滅菌的配好培養基不能長時間放置,更不可隔夜。
4、滅菌時要保證恒溫、恒壓,同時要保證有效滅菌時間。
5、滅菌過的培養基要冰箱保存,可保存一周,一般不超過3天。而且要遵循“先入先出”原則,先配制的要先使用。
6、在使用時,要根據當班次的使用量,用水浴鍋先將培養基溶化為液態,然后及時調低水域溫度(先化好的可從水域取出,放在水浴鍋鍋蓋上)待用,千萬不可長時間使培養基處于高溫狀態。
7、做產品微生物檢測時,傾倒培養基溫度在 45℃左右,不可過燙,避免將菌燙死;也不可過涼,化好的培養基又結塊凝固,不便于觀察結果。
8、每瓶培養基均要做空白。
9、盡量集中做樣,避免頻繁打開同一瓶培養基瓶塞,增大培養基的污染幾率,出現誤差結果。
10、培養基剩余過少時,可先將其傾倒成空白用板。
二、做樣環境的維持
1、大環境(房間)
1)做樣時,窗戶和空調要關閉,或用酒精對房間進行噴霧消毒,避免房間內空氣流通影響安全柜內部環境(最好在有通排風系統的恒溫恒濕無菌間進行操作)。
2)如果在原來的原料微生物檢測室進行做樣,要定期開啟紫外燈,對房間進行殺菌。
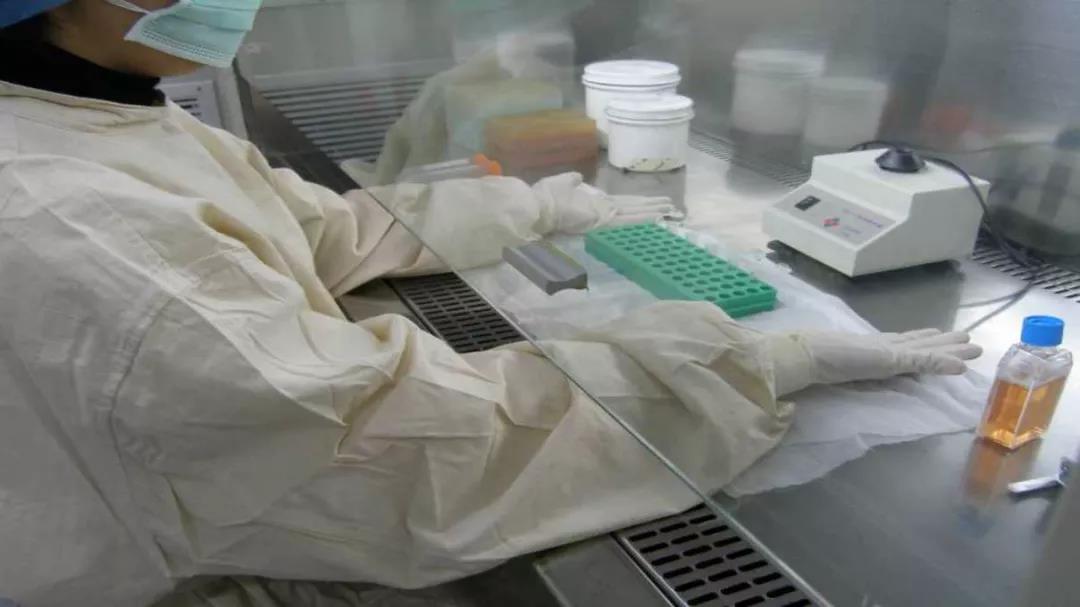
2、小環境(生物安全柜)
1)工作前準備
a.首先紫外燈照射30分鐘
b.關紫外燈,打開安全柜的日光燈和風機,用消毒劑對生物安全柜的內表面進行消毒擦拭
c.將實驗中需要用到的物品集中用消毒劑擦拭后放在臺面相應位置上(切記勿阻擋風口!)
d.等待5min,凈化工作區的空氣污染物
2)操作規范
a. 雙臂垂直緩慢進入前面的開口,在生物安全柜中等待大約一分鐘,以使安全柜調整完畢后才可對物品進行處理。
b. 所有操作應在離前窗10cm以外的工作區進行。
c. 廢棄物應丟棄在生物安全柜內的處理容器中。
3)操作時注意事項
a. 雙避免胳膊在前開口處快速移動和頻繁進出
b. 盡量避免污染的物品進入潔凈區
c. 避免使用明火干擾氣流,可使用微型電加熱器,最好使用一次性接種環。
d. 在生物安全柜內進行操作時,不能進行文字工作
e. 盡量減少操作者身后的人員活動。
4)工作結束后的要求
a.將安全柜繼續運行至少3min來完成“凈化”過程
b.將柜內物品移出前,應使用有效的消毒劑擦拭(特別是霉菌)
c.每天實驗結束后,對生物安全柜的內壁和臺面進行擦拭
d.等待5分鐘后,關閉前窗,關燈,關風機,紫外燈照射30分鐘



三、工器具的潔凈度
1、玻璃器皿:采用干熱滅菌方式進行滅菌。
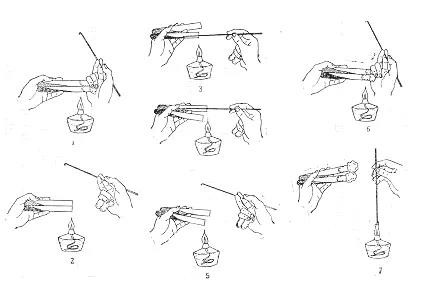
2、做樣用剪刀、勺子等物品要做到做樣專用,不可與其它操作器具混用,使用時,先用75%酒精消毒,再采用灼燒方式進行滅菌。
3、接種針(環)采用灼燒方式進行滅菌,但要注意做樣時要先將接種針(環)進行冷卻。
四、樣品的采集及檢測
1、保證采樣器具的無菌性
1)玻璃器皿:采用干熱滅菌方式進行滅菌,保證恒溫、時間足夠(但不可時間過長,導致玻璃器皿易裂紋而報廢)。
2)取樣筐:使用前要用75%酒精進行噴灑消毒。
3)取樣勺:要保證其清潔消毒,清潔后用75%酒精進行擦拭消毒。
4)取樣袋:可先用酒精進行擦拭消毒,再在安全柜用紫外燈照射消毒,(包裝車間要在傳遞窗用紫外燈照射消毒)。
5)電子稱表面用 75%酒精消毒。
2、人員操作
1)保證手部的清洗、消毒:取樣前及做樣前都要先洗手再消毒。
2)取樣要具有代表性(隨機樣、目的樣、綜合樣)且要標示清楚。
3)取樣完畢,不可在車間逗留,要及時將樣品放入安全柜,對其外表面進行紫外燈照射消毒。
4)在要求的做樣區域進行操作。
5)做樣前,要用 75%酒精棉球對樣品袋口部進行擦拭消毒,再開口。
6)往鹽水瓶加樣品時,要注意勺子或袋子盡量不接觸瓶口。
7)樣品計量要準確,稀釋倍數也要準確(1mL 吸管不允許將管口敲掉),進行 100 倍稀釋時,1mL 吸管要伸入鹽水中,不可以將樣品從管壁流下去,同時要避免將管底部捅破。
8)鹽水溫度以 40℃左右為宜,不能過熱,會將部分微生物燙死;也不能溫度太低,不能將樣品溶解完全。
9)進行稀釋時,要搖勻,保證溶液的均一性。
10)傾倒平皿時,要注意培養基瓶口不要接觸到平皿;傾倒的培養基要適量,不可以太少,在培養過程中干掉,微生物亦死亡,以 15mL 左右為宜。
11)做大腸菌群樣時,要提前將乳糖膽鹽培養基培養管按需要量備好,放入安全柜對外表面進行紫外線滅菌。
12)接二步時,要注意先將接種針(環)進行冷卻,避免出現接不上菌落的情況發生,導致無法判斷、確認。
13)做樣完畢,及時放入相應培養箱進行培養,并清理清潔安全柜。
五、微生物的培養
1、在培養過程中,要隨時監控培養箱溫度,保證其在適宜的溫度進行培養。
2、要按照《微生物檢驗規范》要求及時觀察結果,出現異常,要及時分析原因進行反饋。














 當前所在頁面:
當前所在頁面: