大腸菌群(Coliform bacteria)是指一群能發酵乳糖、產酸產氣、需氧和兼性厭氧的革蘭氏陰性無芽胞桿菌。該菌主要來源于人畜糞便,故以此作為糞便污染指標來評價食品的衛生質量,推斷食品中是否有污染腸道致病菌的可能。大腸菌群分布較廣,在溫血動物糞便和自然界中廣泛存在。
調查研究表明,大腸菌群多存在于溫血動物糞便、人類經常活動的場所以及有糞便污染的地方。人、畜糞便對外界環境的污染是大腸菌群在自然界存在的主要原因之一,糞便中多以典型大腸桿菌為主,而外界環境中則大腸菌群的其他菌株較多。
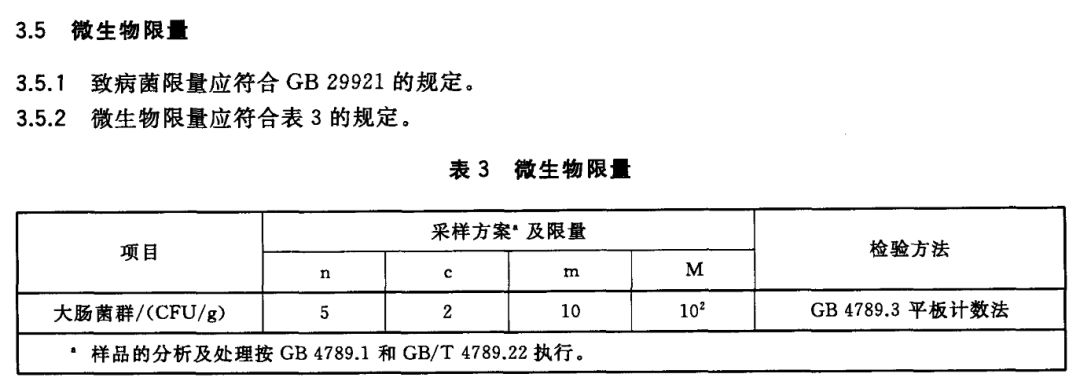
大腸菌群檢測的關鍵在于方法的選用,食品中大腸菌群檢測有兩種表示方法,其一是以100mL(g)檢樣內大腸菌群最大可能數(MPN)表示,檢測方法需使用GB/T 4789.3-2003《食品衛生微生物學檢驗大腸菌群測定》;
其二以每g(mL)樣品中大腸菌群的MPN值表示,檢測方法需使用GB 4789.3-2016《食品安全國家標準 食品微生物學檢驗 大腸菌群計數》。GB/T 4789.3-2003《食品衛生微生物學檢驗 大腸菌群測定》雖然被后更新的方法代替,但衛生部關于規范食品中大腸菌群指標的檢測工作公告(2009年 第16號)明確指出,為規范食品中大腸菌群指標的檢測工作公告如下:
現行食品標準中規定的大腸菌群指標以“MPN/100克或MPN/100毫升”為單位的,適用《食品衛生微生物學檢驗大腸菌群測定》(GB/T 4789.3-2003)進行檢測;以“MPN/克或MPN/毫升”、“CFU/克或CFU/毫升”為單位的,適用《食品衛生微生物學檢驗大腸菌群計數》(GB/T4789.3-2008)進行檢測。后GB/T 4789.3-2008被GB 4789.3-2016替代,故檢測樣品前需根據產品標準認真選擇方法。
例如,GB/T2717-2003醬油衛生標準中對大腸菌群的要求需使用方法一GB/T 4789.3-2003。又如GB/T 2718-2014醬油衛生標準中對大腸菌群的要求需使用方法二GB4789.3-2016。

MPN檢索表使用
GB/T 4789.3-2003檢索表中陽性管數是以1mL(g)×3、0.1mL(g)×3和0.01mL(g)×3的梯度進行表示,GB 4789.3-2016陽性管數是以0.10、0.01和0.001的梯度表示,均按照稀釋倍數推算結果,結果相同。推算方法以GB 4789.3-2016為例,改用1g(mL)、0.1g(mL)和0.01g(mL)時,表內數字應相應降低10倍;如改用0.01g(mL)、0.001g(mL)和0.0001g(mL)時,則表內數字應相應增高10倍,其余類推即可。
1、大場菌群在LST培養基里陽性結果

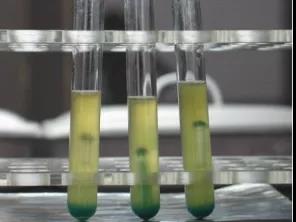
2、大場菌群在BGLB培養基里陽性結果
3、大場菌群在結晶紫中性紅膽鹽瓊脂VRBA上的菌落特征
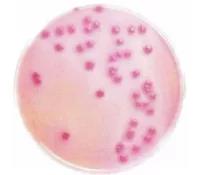
4、大場菌群在去氧膽酸鈉鹽瓊脂上的菌落特征

5、大場菌群在伊紅美藍瓊脂上的菌落特征
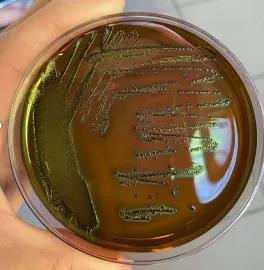
6、大場菌群在顯色培養基上的菌落特征
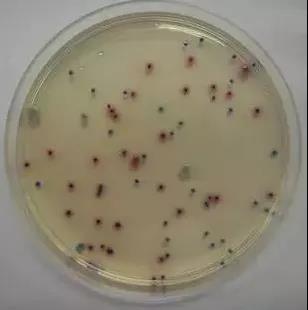
四、大腸菌群檢驗MPN法接種量剖析:
接種量問題,GB 4789.3 -2016中 7.2 初發酵試驗規定“選擇3個適宜的連續稀釋度的樣品勻液,每個稀釋度接種3管LST肉湯,每管接種1mL(如超過1mL,則用雙料LST)”。這里所說的接種量1mL并非1mL樣品接種量(即MPN檢索表中的1mL樣品接種量),而是接種的稀釋液的體積V=1mL(為了區分,本文中用V表示),那么實際的接種量m(為了區分,本文中用m來表示)為m×p(p為稀釋液濃度)。那么括號中的接種量超過1mL就是要V>1mL,而MPN檢索表中的實際接種量都為10-n系列數,所以V也只可能是10mL(100mL在實際中不可能),也就是說接種體積V=1mL,用單料,V=10mL用雙料。
例如:25g樣品+225mL緩沖液—1:10稀釋液
1:10稀釋液+9mL緩沖液—1:100稀釋液
若:1:10稀釋液接種10mL至雙料LST,接種量為:10mL×0.1g/mL=1g
1:10稀釋液接種1 mL至單料LST,接種量為:1mL×0.1g/mL=0.1g
1:100稀釋液接種1 mL至單料LST,接種量為:1mL×0.1g/mL=0.01g
培養基裝量在GB 4789.3-2016中沒有作任何說明,所以各人的理解更是不一,可能有的人單雙料都用10mL,有的人用9mL,有的更多或更少。那么到底培養基裝量有沒有什么規則,是不是怎樣都行?
其實不是,GB/T 5750.12—2006中總大腸菌群檢測方法中2.1.5.1.1中使用的是單料雙料都是10mL,這實際上是為了使得接種稀釋液后所有的發酵管培養基濃度達到培養基本身的使用濃度。雙料10mL,再接種10mL稀釋液后濃度降低一倍就還原了培養基本身的使用濃度,而單料它本身就是培養基的使用濃度,那么接種1mL稀釋液后為了使培養基的濃度不至降低太多,就要讓培養基裝量盡可能的多,但是試管的裝量也是有限度的,所以選擇裝量在10mL左右比
1、MPN法注意事項:
•全過程不得超過15min。
•樣品勻液的pH值應在6.5~7.5之間,
•(如接種量需要超過1mL,則用雙料LST肉湯)
•以48h±2h為最終觀察結果時限。結果也以此時為最終結果。
2、MPN法培養基:LST、BGLB:
(1)月桂基磺酸鹽胰蛋白胨(LST)
月桂基磺酸鈉能抑制革蘭氏陽性菌的生長,同時比膽鹽的選擇性和穩定性好。由于膽鹽與酸產生沉淀,沉淀有時候會使對產氣情況的觀察變得有些困難;
•乳糖是大腸菌群可利用發酵的糖類。有利于大腸菌群的生長繁殖并有助于鑒別大腸菌群和腸道致病菌;
•胰蛋白胨提供基本的營養成分;
•LST肉湯是國際上通用的培養基,與乳糖膽鹽肉湯的作用和意義相同,但具有更多的優越性。
•發酵試驗判定原則:產氣為陽性。
•檢測步驟減少(不必分離培養),檢測時間縮短24h。
•注:如接種量超過1mL,則應用雙料LST肉湯
(2)煌綠乳糖膽鹽肉湯(BGLB)
膽鹽可抑制革蘭氏陽性菌。
•煌綠是抑菌抗腐劑,可增強對革蘭氏陽性菌的抑制作用。
•乳糖是大腸菌群可利用發酵的糖類。有利于大腸菌群的生長繁殖并有助于鑒別大腸菌群和腸道致病菌。
•發酵試驗判定原則:產氣為陽性。由于配方里有膽鹽,膽鹽遇到大腸菌群分解。
•乳糖所產生的酸形成膽酸沉淀,培養基可由原來的綠色變為黃色,同時可看到管底通常有沉淀。
3、MPN檢索表的應用:
MPN(最可能數most probable number)是表示樣品中活菌密度的估測。因此MPN值只是活菌密度的估算值,并不是樣品中活菌數的真值。
4、使用MPN檢索表的注意點:
•這個MPN檢索表是ISO、FDA、AOAC、USDA/FSIS、北歐等標準通用的。
•表里的數字是有小數點的。
•報告單位不同。現報告單位為g/ml,而原報告單位是100g/ml。
•原標準MPN表有64個組合,而現標準MPN表只有40個組合。
當實驗結果在MPN表中無法查找到MPN值時,如:陽性管數為122,123,232,233等時,建議增加稀釋度(可做4~5個稀釋度),使樣品的最高稀釋度能達到獲得陰性終點(如果污染程度不能判定,則多加一稀釋度),然后再遵循相關的規則進行查找,最終確定MPN值。














 當前所在頁面:
當前所在頁面: