近年來,隨著藥物研究的不斷深入以及雜質研究要求不斷提高,雜質的分析技術以及研究方法正發生著重要的改變。在對雜質建立分析方法時,清晰的雜質研究過程是方法建立的基礎,而且選擇合適的分析技術也至關重要。
一、雜質的來源分析
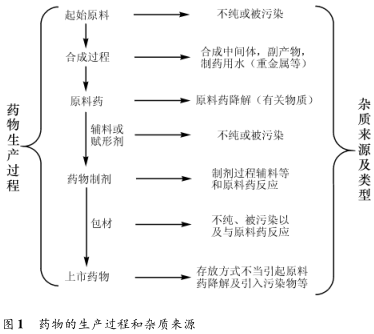
藥物中的雜質可能來源于藥物生產以及銷售等各個環節(圖 1)。根據 ICH指導原則可將藥物雜質分為有機雜質、無機雜質、殘留溶劑以及其他雜質。本文主要針對有機雜質進行探討。
對藥物雜質研究時引入“質量源于設計( Quality byDesign,QbD)”的理念,可在藥物生產之前根據具體工藝的合成機制、起始物料及各中間體的基本結構,初步勾畫出產品的雜質譜。
雜質來源分析是制定藥物雜質控制策略的基礎,尤其是在對毒性雜質來源分析時,應分析所有合成和生產工藝中的試劑、中間體、副產物,推測可能產生的潛在雜質以及分析實際存在的雜質。
在原料藥合成結束后,藥物的活性化合物雖然經過毒性分析已不含有“警示結構”(alerting structure),但是在生產過程中使用到含有警示結構的化合物則還需考慮其遺傳毒性。
二、雜質的研究方法
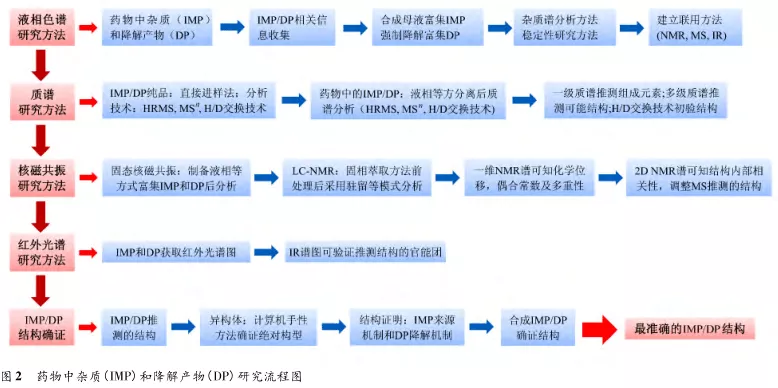
在藥物研發過程中,藥物雜質的分析是關鍵。因此,在雜質研究中清晰的雜質結構研思路(如圖2)以及合適的雜質分析技術可極大地縮短雜質研究時間,推動著藥物研究的快速發展。
1、雜質前處理技術
雜質的前處理是伴隨著藥物活性成分前處理而存在的,然而藥物中雜質的含量低且其結構與主成分差異較大,因此常規藥物活性成分的前處理和檢測方法(如初始流動相溶解后直接進行 HPLC-UV 分析)并不一定適用于藥物雜質,應針對不同的樣品選擇不同的前處理技術。
(1)檢測靈敏度低的樣品
對檢測靈敏度低的樣品通常使用衍生化的前處理方式,比如引入生色團產生紫外響應,或增加易離子化基團增加離子化效率等。
雖然常規衍生化方式能夠滿足日常檢測的需求,但是為了實現對低濃度的基因雜質進行快速篩選和定量,可對傳統的衍生化試劑進行改變以增加其專屬性和靈敏度,也可使用氣-固衍生化來彌補液-固衍生化的不足。
(2)低濃度的雜質
低濃度雜質前處理方法的選擇根據其雜質類型所決定,如降解產物利用強制降解等方法提高降解物的濃度等,但是常規的降解方法往往會引入其他雜質,因而會干擾特殊雜質的雜質譜研究,為了得到單一的雜質研究機制,Ueya-ma 等提出了一種新型的固體藥物氧化降解平臺,該平臺排除了常見氧化方式(例如 H2O2 主導)引起的水解、溶劑解或熱效應等,可用于氧化降解機制的特異性研究。
(3)易污染儀器的樣品
不同儀器有不同的使用條件,因此對復雜樣品進行前處理工作能夠延長儀器的使用壽命,例如質譜檢測器不能使用含有非揮發性鹽的流動相,因此在建立液質聯用條件時可利用二維液相色譜技術在第一維將各峰進行分離并將樣品保留至樣品環中,第二維液相使用質譜可接受的流動相以及脫鹽柱來洗脫樣品環中的樣品從而實現了被分析物“脫鹽”來保護質譜。
2、雜質分離技術
雜質在藥物中含量較低,利用直接測定法無法實現雜質的定性定量分析。因此,應對雜質進行分離以獲取雜質的單一成分,從而實現對雜質的檢測。近年來,液相色譜技術以及超臨界流體技術發展較為迅速。
(1)液相色譜技術
高效液相色譜技術(HPLC) HPLC 作為最傳統的方法在雜質分離中仍然使用得最多。通過各種色譜柱技術以及聯用技術能夠對絕大多數化合物實現分離、分析。為了解決與紫外檢測器聯用靈敏度低的問題,新型二維 高 效 液 相 色 譜 (2D-HPLC)利用了液相色譜技術分離和富集的特點提高了對低濃度雜質的檢測能力。
目前,HPLC 無論采用正相洗脫還是反相洗脫都需消耗大量的有機溶劑,這對環境帶來較大的污染,因此提出以水或其他環境友好的試劑為主要洗脫溶劑的新型液相色譜技術正得到廣泛的研究。超高效液相色譜技術(UHPLC) 為了應對藥物研發的需要,UHPLC 作為一種快速分離的色譜技術已經出現在各種藥物的開發上。
Dong 等根據UHPLC 的使用方法,討論了如何針對不同樣品建立穩定的UHPLC方法。手性分離方面,UHPLC目前并沒有大量小于2μm 粒徑的商品化手性色譜柱,但是利用傳統的手性流動相添加法也可實現對手性雜質進行分離。
在實驗室建設方面,分析實驗室目前仍以 HPLC 為主要研究儀器,但為了獲得類似于UHPLC 分離效能,許多科研工作者通過優化 HPLC系統同時使用核殼型色譜柱實現了快速分離。
(2)超臨界流體色譜(SFC)
以液態CO2 為主要流動相的SFC 技術,由于其與紫外聯用檢測靈敏度低,其發展一直非常緩慢,但質譜檢測器(MS)的普及以及環境友好型社會的需要,使 SFC 能用于分離手性雜質。雖然 SFC 與質譜聯用技術用于雜質分析已有相關報道 ,但商品化的 SFC-MS聯用儀器并未大量出現。
3、雜質制備與純化技術
為實現對雜質的定量及定性分析,需要獲取高純度單一成分的雜質,然而雜質在藥物中含量較低,利用分析型液相色譜技術制備雜質需要消耗大量時間,利用制備型液相色譜技術等方法可提高高純度雜質的獲取速度,加快雜質研究工作。
(1)制備型液相色譜技術和制備型SFC技術
經純化的雜質可獲得更高質量的圖譜,但藥物中雜質含量低的問題一直制約著雜質單體的獲取速度。利用液質聯用方法可獲得雜質的來源與簡單結構,再利用強制降解 、結晶母液或直接合成等方式可制備出雜質單體制備技術上。
為了克服常規一維制備型液相色譜技術以及制備型SFC 色譜技術的方法建立困難、制備時間較長等缺點而提出制備型的二維液相色譜技術(Prep 2D-LC)以及二維 SFC 色譜技術已得到越來越多的應用。
Zhang 等提出了一種新型的 Prep 2D-LC,該儀器首先通過一維液相色譜對樣品進行初步分離,并用質譜相對分子質量監控和中心切割的方式將目標物保存在樣品環(Sample loop)中,再利用在柱洗脫(at column dilution)的方法將樣品環中的樣品進樣至第二維液相色譜中,第二維液相色譜通過使用與第一維相同或者不同的流動相對樣品進行進一步分離同時使用質譜監控方法即可得到更高純度的目標物。
這種新方法不僅替代了一維制備型液相色譜,同時解決了傳統制備2D-LC 系統高壓以及峰展寬的問題。類似于2D-LC,該課題組也提出了2D-SFC 制備技術以用于手性和非手性化合物的篩選 。
(2)其他制備技術
藥物中雜質含量低,利用液固吸附分離的方式會造成雜質損失,延長制備時間。逆流色譜技術 ( counter-current chromatogra-phy,CCC)通過液液萃取方式使雜質吸附達到最低,樣品重現性能夠達到 100%,而且有報道將制備液相色譜技術和 CCC 進行對比,結果表明 CCC對溶解度低的樣品的上樣能力和高通量能力都優于制備液相色譜。
與 CCC 類似的離心分配色(centrifugal partition chromatography,CPC),利用流體靜力分配方式實現對藥物的純化作用,但CPC 在使用中會出現固定相流失以及流速不穩定脈沖的問題,Amarouche 等 通過引入順流洗脫(co-current elution)方法解決了上述問題并成功地對不溶性環孢素 A 進行了純化。
為了實現快速制備與純化,通過空氣加壓加速液固分離的快速質譜(flash chromatography,FC)也不失為一種大量制備化合物的方法。
4、雜質檢測技術
雖然 HPLC-UV 技術可對大部分藥物雜質進行定量分析,但由于紫外檢測靈敏度低而無法實現對極微量雜質的準確定量。然而,質譜技術擁有高靈敏度和高分辨率等優點,近年來由于其具有卓越的定量和定性分析能力已得到了快速的發展。同時,減少樣品消耗量也是不斷推動核磁共振技術的發展動力之一。
(1)質譜技術(MS)
定量分析:質譜技術可作為紫外無響應雜質的一種替代定量手段,同時因其具有較高的檢測靈敏度,能夠對紫外單波長檢測無法定量的痕量雜質得以準確測定。但在對某些特殊雜質測定時,由于離子化能力弱仍需要通過衍生化或在流動相加入堿金屬離子等方法以獲取質譜響應 。
常規 MS檢測器由于分辨率的制約導致對痕量雜質的定量準確性不高,而高分辨率質譜(HRMS)能將被分析物的荷質比(m/z)檢測相對誤差降到1×10-6~2×10-6,在選擇離子掃描定量中提高了對痕量分析物的定量準確度。
HRMS高分辨率的另外一個優點是質量區分更為準確,這可用于區分相對分子質量相近的多種化合物,利用此優勢和 UHPLC聯用能在短時間內實現對多種雜質的分離定量 。
結構鑒定:對雜質單體進行結構鑒定耗時長,因此在藥物的雜質譜分析中使用液質聯用的方法可對雜質結構進行快速鑒定。該方法是以一級質譜確定的分子離子峰進行二級質譜碎裂分析。
然而,質譜分辨率的不足常使母離子的 m/z 判斷不準,從而造成雜質的元素組成不明確,同時二級碎片信息量不足也阻礙了對雜質結構的進一步解析。因此,HRMS、多級質譜(MS n )以及氫/氘(H/D)交換等技術以其各自的優點能夠對雜質結構做出準確的解析。
質譜分辨率的提高增加了相對分子質量信息的準確性并可準確預測元素組成,同時利用質譜內置軟件或其他計算軟件 可計算出不同分子式得分高低。
質譜分辨率提高也有區分不同同位素的功能,例如相對分子質量為 500 左右的分子,只有分辨率達到 400000 才能將質譜圖中的34S和37Cl兩種同位素峰分離開。
(2)核磁共振技術(NMR)
NMR 技術在雜質定性和定量應用中主要依賴于獲得雜質單體,另外,在特殊雜質質量標準建立時對雜質對照品的標化可利用定量NMR進行 。NMR技術同時也是一種質量相關檢測技術,使用NMR技術求算校正因子進而校正其他檢測器,可實現對反應進程的監控。NMR技術檢測靈敏度依賴著探針的性能。
因此,為了提高NMR檢測靈敏度,有研究者發明了致冷探針,這種探針只需微克級別的化合物單體就能實現對化合物檢測,這使NMR檢測樣品消耗量實現了由毫克向微克的飛躍。同時在線的液相-核磁(LC-NMR)聯用技術也能實現藥物雜質的快速結構鑒定 。
5、新型的分析技術
隨著快速雜質分析以及結構鑒定準確性的需要,也有一些方法被用于雜質的結構鑒定,如藥物雜質直接測定技術 、以分子印跡法(MIP)建立同類雜質碎片數據庫以及單晶 X 線衍射技術等。
三、基因毒性雜質的分析
基因毒性雜質能直接作用于人體中的 DNA,造成 DNA 損傷而具有致癌、致畸或致突變的性質。少量的基因毒性雜質也能對人體造成極大的損害,對基因毒性雜質的研究已引起了藥物研究者的廣泛關注 。
1、定量分析
由于基因毒性雜質危險性極大,美國 FDA 和歐洲藥品管理局(EMA)規定了毒理學擔憂閾值(TTC):人在長期用藥時,潛在毒性雜質每日攝入量不能超過1.5 μg 。
根據上述規定,每天藥物服用劑量是 200mg,則毒性雜質的質量分數不應超過7.5-×10-6 ,因此對基因毒性雜質定量分析需要痕量分析的方法。
常用的紫外檢測器最低能夠對質量分數5×10-4的雜質進行檢測,但隨著 2D-HPLC的發明以及高靈敏度紫外檢測器的使用,藥物中痕量雜質經一維液相儀分離、固相萃取技術富集及二維液相儀高靈敏度檢測也能實現準確定量。
但是,這種方法需要多次高濃度進樣并不適合雜質含量測定。
因此,質譜檢測技術是建立基因毒性雜質定量分析方法的重要前提。Kakasaheb等 對坎地沙坦中合成起始原料中的基因毒性雜質利用 GC-MS 的方法進行定量測定,方法學驗證結果能夠符合 ICH 規定的要求,該方法適用于上市藥品中基因毒性雜質的含量測定。
在痕量的雜質進行方法建立過程中,樣品的前處理方式十分重要,微量的損失可能對結果造成極大的影響,Devenport 等創新性地在大氣壓條件下利用質譜直接定量出模擬藥物中基因毒性雜質,這種方法使樣品測定更加便捷,并可實現對藥物的高通量檢測。
2、毒性雜質的確
2006 年,EMA 發布了遺傳毒性限度的指導原則,此后 ICH、FDA 以及我國的藥品審評中心也提出了對基因毒性雜質的研究和控制方案。根據相關的指導原則,即使雜質的含量在規定的定量要求以下也需要對雜質進行毒性評估。
對化合物毒性評估是通過體外細菌毒性實驗實現的,同時指導原則推薦使用雜質單體進行研究。然而,藥物中的毒性雜質都是微量或痕量存在的,通過制備等方法獲取雜質單體耗時長且成本高。
為此,FDA 和其他公司共同開發了計算機軟件用于評估化合物的毒性。此軟件無需獲取單體,對雜質的結構進行鑒定后,即可使用毒性評估軟件評估雜質的結構是否存在警示結構。
在軟件方面,FDA 推薦使用MC4PC、MDL-QSAR 以及 Derk for Window 等進行評估。為了對毒性得以準確性的評估,每種軟件擁有特殊的算法和適用范圍:
MC4PC軟件是將待評估的結構拆分成 2~3 個(非氫)原子的結構碎片,再將這些碎片與已知毒性化合物碎片數據庫進行比對,對雜質結構中的碎片做出了毒性累加得分并描繪結構的分子特征,最終生成一個全面而且專業的報告評估雜質的結構毒性。
雖然 MC4PC能夠從雜質的精細結構角度評估藥物的毒性,但是其只能在已有的數據庫中搜索相同的碎片進行比較,對多于一種未知碎片的結構卻不能全面評估。
毒性化合物的研究結果表明毒性化合物結構中都存在著親電子基團或可被激活為親電子基團的結構,MDL-QSAR毒性評估軟件是基于化合物的毒性和該化合物的親電能力的相關性做出評估,這種軟件可計算出化合物結構與其毒性的定量關系,同時可以預測體外細菌毒性實驗的結果。
然而,為了達到對已知結構的雜質毒性的最準確評估,使用 MDL-QSAR軟件時需尋找到最適合的模型用以計算,因此在該計算軟件提出后,有許多關于不同的數據模型以及對它們的評估的報道。
有些雜質雖經計算機評估結果為有警示結構的潛在毒性雜質,但由于評估軟件在計算過程中會過分評估雜質的毒性,所以在判定藥物雜質是否為毒性雜質仍需要進行體外細菌回復突變實驗(Ames 實驗)或哺乳動物細胞分析,FDA對該實驗的過程給予詳細的說明。
3、控制方法
根據 EMA 指導原則以及對指導原則問題解答,藥物中所有存在的化合物均應該通過化合物毒性評估或符合指導原則的控制方法,同時為了確定潛在毒性雜質是否為毒性雜質需要進行Ames實驗。
四、展望
雜質研究在藥物研發過程中占有及其重要的地位,不僅影響著新藥上市的速度,更影人類用藥安全。隨著分析技術的不斷發展,雜質研究的策略已經變得愈發多樣化。隨著檢測器分辨率以及靈敏度的提高,雜質定量實現了由微量到痕量的飛躍,雜質的定性工作也實現了由離線到在線檢測的轉變。然而,新藥研發速度的加快,生物藥物的不斷涌現以及快速定性定量分析的要求,將給研究人員帶來極大的挑戰。














 當前所在頁面:
當前所在頁面: